
不差!國產新冠藥物試驗結果發布,何時上市PK進口“神藥”?
當地時間12月28日,《新英格蘭醫學雜志》發布了國產抗新冠病毒藥物VV116的一項Ⅲ期臨床研究結果,發現在因輕、中度新冠感染而住院,且有疾病高風險的成人中,使用 VV116 進行為期 5 天的口服治療,效果并不劣于“新冠明星藥”Paxlovid。
這也是全球權威期刊《新英格蘭醫學雜志》(NEJM)發表的首個中國自主研發的新冠創新藥臨床試驗。
今日(29日),中日友好醫院呼吸與危重癥醫學科曹彬教授在《NEJM醫學前沿》發表評論稱,該研究首次報道了奧密克戎流行情況下,使用VV116和Paxlovid對高危因素的人群癥狀改善時間的數據,為后續臨床試驗設計以及臨床用藥指導提供重要參考價值。

本次研究由上海瑞金醫院牽頭開展,招募了2022年4月4日至5月2日上海奧密克戎疫情期間,7家醫院共822名新冠患者,按1:1的比例分配至VV116組和Paxlovid組。
最終,384名和387名分別接受兩種藥物治療的患者被納入分析,中位年齡為53歲,至少具有一項進展為重癥新冠感染的高危因素,如 60 歲或以上 (37.7%),高血壓(35.1%)、體重指數BMI>25(32.9%)等。
在研究主要終點——至持續臨床恢復的時間上,相比于Paxlovid,使用VV116達到非劣效應,且VV116組比Paxlovid組的中位恢復時間更短(4天VS 5天)。
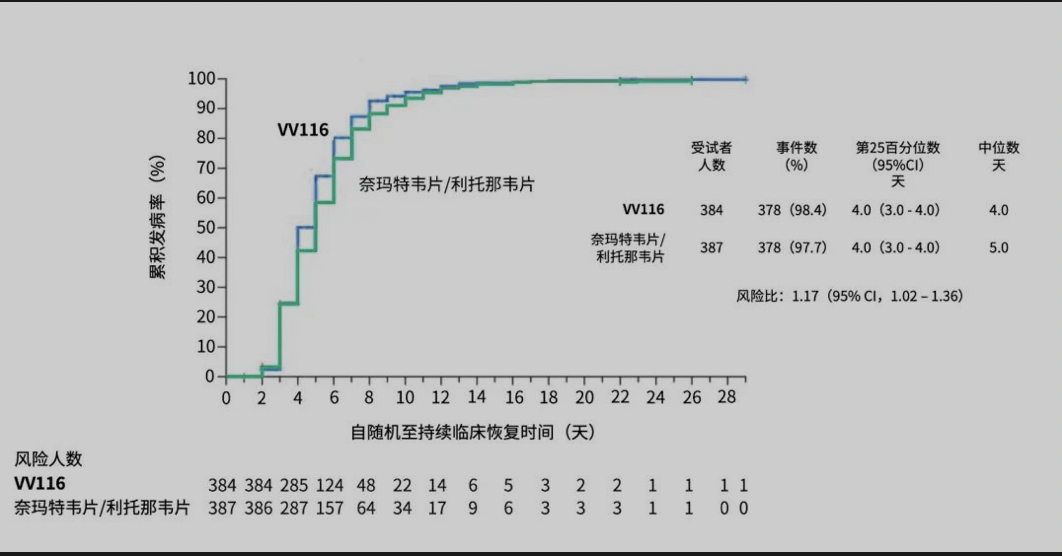
次要療效終點包括截至第28天,進展為重度/危重新冠或全因死亡的患者比例、新冠相關癥狀評分、至持續癥狀消失的時間、SARS-CoV-2核酸陰性時間等。
VV116組和Paxlovid組在“至持續癥狀消失的時間”、“至首次SARS-CoV-2核酸陰性時間”方面表現類似,中位時間均為7天。在每一個預設時間點(第5、7、10、14、28天),VV116組癥狀緩解的患者比例,均高于Paxlovid組。兩組患者均未發生進展為重度/危重COVID-19(新冠)或死亡。
安全性方面,VV116組報告的不良事件少于Paxlovid組(67.4%對77.3%),3級或4級不良事件也更少(2.6% 對 5.7%)。
美國“錯失的機會”?
VV116是我國首個自研靶向新冠病毒RdRp小分子抑制劑,最初由上海藥物研究所沈敬山團隊根據美國吉利德公司抗病毒藥物Remdesivir(瑞德西韋)改造而來,是Remdesivir體內活性代謝物——GS-441524的結構修飾物。
2021年9月28日,沈敬山教授及相關科研人員發表于Cell Research的文章稱,新冠暴發之初,團隊對各類核苷/核苷酸類似物的抗病毒藥物進行了篩選,發現Remdesivir及其母體核苷GS-441524可以顯著抑制新冠病毒的復制。
Remdesivir具有肝臟靶向性,可肺才是受新冠病毒影響最嚴重的器官,因此團隊選擇了對GS-441524進行結構修飾,提高對新冠病毒的成藥性,最終發現了VV116。
今年7月,美國媒體“Quartz”發文,稱中國開發VV116的故事是美國錯失的機會之一。報道認為,吉利德沒有采取任何行動盡快將GS-441524用于正式的臨床試驗,相反選擇了押寶Remdesivir。
“無論如何,中國做了吉利德不會做的事,押注于GS-441524的功效。圍繞吉利德的專利,中國科學家找到了一種創造性的方法,對GS-441524進行結構修飾,并于2020年4月為VV116 提交了專利申請。結構修飾并沒有從根本上改變 GS-441524 的治療特性,但差異足以避開吉利德的專利范圍。”報道稱。
江蘇開元藥業新藥總監、藥物化學博士胡詩合告訴“醫學界”,VV116突破了原研專利,最終得到的藥效結果良好,說明這項研發工作是成功的。“過程肯定包含了大量結構改造工作,反復嘗試,直到合成、篩選出認為可能是最好的結構。”
胡詩合博士進一步解釋道,Remdesivir真正發揮抗病毒作用的核心結構,是其游離核苷形式GS-441524,但最初Remdesivir的結構設計是做成肝靶向。
“而VV116結構設計的目標,是口服給藥,將分子遞送入血液循環,進行的結構修飾也提高了其在循環中的穩定性,不易被代謝,長時間保持活性結構并運送到目標,起到抗病毒作用。”胡詩合博士說,“通俗地形容,就是盡可能讓藥物到達靶目標,起到抗病毒作用,因此VV116體內活性強于Remdesivir也很正常。”
除本次《新英格蘭醫學雜志》發表的Ⅲ期研究,今年5月18日,華山醫院感染科旗下公眾號“華山感染”還發布了VV116針對奧密克戎感染者的首個臨床試驗研究結果,表明在核酸陽性5日內服藥,轉陰時間為8.56天,小于對照組11.13天。
“Quartz”報道認為,若VV116最終被證明有效,或可與Paxlovid結合使用。由于它們分別作用于抗新冠病毒的不同機制,理論上將是一個不錯的組合。
或無法減少重癥發生
本次Ⅲ期臨床試驗最初設置了兩個主要終點,分別是患者“轉重癥”和“癥狀恢復” 的時間,而在試驗中,研究人員放棄了“雙終點”,僅探索了患者的持續癥狀恢復時間,此前這一改變也引發了一定的爭議。
對此,曹彬教授在前述評論中分析,可能是因為試驗執行過程中發現奧密克戎致病性下降,導致重癥事件發生概率極低,研究人員只能放棄“重癥”這一實驗指標。而也正如預期,結果表明兩組(VV116和Paxlovid)進展為重型的受試者人數為0。
“從目前情況來看,靶向減少重癥發生這一適應癥已經基本不可能完成,針對新冠門診輕癥患者的癥狀改善適應癥,是目前尚未被滿足的臨床需求。”曹彬寫道。
評論分析,面對迅猛發展的新冠疫情,我國亟需高效抗新冠病毒藥物。盡管輝瑞公司的Paxlovid(奈瑪特韋-利托那韋)和國產原研藥阿茲夫定早已獲得應急附條件批準,但或由于供應不足等原因,還遠不能滿足臨床需求。
據“21財經”報道,《新英格蘭醫學雜志》發文后,君實生物A股、H股均漲超10%,君實生物投資關系部門相關人士稱,目前VV116還未提交上市申請,跟藥監部門保持持續溝通。“目前監管部門認為還需要更多的數據支持,所以還不支持我們用這個三期臨床研究去提交上市申請。”該人士表示。
醫學界查閱“clinicaltrials.gov”網站后發現,VV116還在進行兩項Ⅲ期臨床,規模分別為1200人和1310人,均為多中心、雙盲、隨機、安慰劑對照研究,目前正處于招募階段。

“不用剩下兩個結果都出來,至少出來一個,我們就會盡快啟動溝通了。”前述人士表示,至于何時獲批無法預測,我們肯定希望越早越好,但是獲批完全取決于監管。
而除VV116外,目前我國外也還有多款新冠治療藥的研發和上市在加速推進之中。
12月26日,江蘇省藥品監督管理局官方微信號發布消息,先聲藥業SIM0417Ⅲ期臨床已完成全部1208例患者入組,進度處于國內新冠3CL靶點治療藥物第一位,最快于明年2月上市。
另據報道,深圳市第三人民醫院臨床試驗中心發布通知,眾生藥業、武漢生物制品研究所、科興制藥也在近期進行陽性患者的招募。三款藥物分別為RAY1216片、F61注射液和shen26膠囊。